Leberresektion
Die sichtbare Einteilung der Leber in einen rechten und linken Leberlappen entspricht nicht dem inneren Aufbau der Leber. Die Trennung in den linken und rechten Leberlappen lässt sich grob abschätzen, wenn eine Linie zwischen Gallenblasenfundus und V. cava gedacht wird. Couinaud teilte die Leber zusätzlich unter anatomischen Gesichtspunkten in acht einzelne Segmente ein, wobei sie im Uhrzeigersinn durchnumeriert wurden. Bei der Numerierung erhielt der Lobus caudatus die Nummer 1 und das Segment 4 wird zusätzlich in a und b unterteilt. Die Einteilung von Couinaud basiert auf der Aufzweigung der V. porta, der A. hepatica und der Gallenwege. Diese drei Strukturen verlaufen gemeinsam, sind von einer bindegewebigen Schicht umgeben und werden als Glisson-Trias bezeichnet. Jedes Segment wird getrennt von einem Ast der Glisson-Trias versorgt. Die drei großen Lebervenen (rechte, mittlere und linke Vene) separieren die Leber in vier Doppelsegmente, die auch Sektoren genannt werden.
Leberresektionen
Die Leberresektionen werden in atypische und typische eingeteilt, wobei eine atypische Leberresektion nicht die anatomischen Segmentgrenzen berücksichtigt. Die typischen Resektionen werden in Segmentresektionen, Sektorektomien und Hemihepatektomien differenziert. Eine Hemihepatektomie rechts umfasst die Segmente 5–8 und die Hemihepatektomie links die Segmente 2–4. Das Segment 1 bzw. der Lobus caudatus wird bei der Resektion immer extra erwähnt. Die linkslaterale Sektorektomie umfasst die Segmente 2 und 3 und entspricht einer Entfernung der Leber linkslateral des Lig. falciforme. Eine Trisektorektomie rechts umfasst drei Sektoren (6/7, 5/8, 4a/b), so dass nur die Segmente 2 und 3 zurückbleiben.
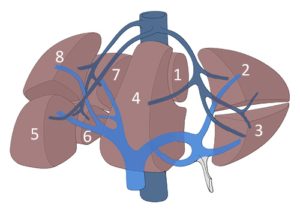
Gefäßversorgung der Leber und Einteilung der Lebersegmente nach Couinaud
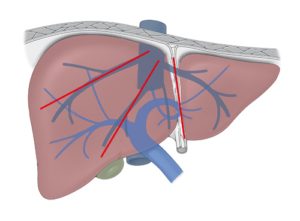
Gefäßversorgung der Leber und Einteilung in Sektoren
Operation
Die Operation an der Leber setzt eine gute Exposition des Organs voraus. Dazu eignet sich besonders der J-förmige Schnitt – querer rechtsseitiger Oberbauchschnitt kombiniert mit einer oberen Mittellinienlaparotomie. Bei einer linksseitigen Resektion ist ein querer Oberbauchschnitt vorteilhaft. Manchmal wird der quere Schnitt in der Mittellinie bis zum Xyphoid erweitert. Dieser sogenannte „Mercedes“-Schnitt hat allerdings den Nachteil, dass sich häufiger Narbenbrüche an der Kreuzungsstelle bilden.
Intraoperative Sonographie
Die intraoperative Sonographie (IOUS) wird herangezogen, um weitere kleine Läsionen auszuschließen, die der präoperativen Diagnostik entgangen sind, um das genaue Resektionsausmaß festzulegen und um die Verhältnisse der Läsion zu den Gefäßen zu sondieren. Bei der Planung wird auf einen ausreichenden Sicherheitsabstand von mindestens ein Zentimeter geachtet.
Mobilisation der Leber
Die Leber wird soweit mobilisiert, dass zu jeder Zeit eine gute manuelle Kompression der zu resezierenden Leberabschnitte zur Blutstillung möglich ist. Dazu werden die Aufhängebänder durchtrennt und die kleinen Venen zur V. cava ligiert. Bei der Mobilisation des linken Leberlappens sollte auf die Phrenicagefäße geachtete werden, die bei einer Läsion zu einer starken Blutung führen können. Die Mobilisation des linken Leberlappens ist unproblematisch. Die Ligg. falciforme und teres hepatis werden durchtrennt, ebenso das Lig. triangulare sinistra. Bei der Mobilisation des rechten Leberlappens sollten die kleinen venösen Abflüsse zur V. cava sorgfältig unterbunden werden. Die linke und mittlere Lebervene ist leicht dissezierbar. Häufig fusionieren sie bereits intrahepatisch und bilden sie einen gemeinsamen Stamm. Die Einmündung der rechten Lebervene ist erst vollständig darstellbar, nachdem das fibröse Band zwischen der rechten Seite der V. cava und dem Lobus caudatus durchtrennt wurde.
Pringle-Manöver
Um eine optimale Blutstillung während der Durchtrennung des Leberparenchyms zu gewährleisten, ist eine präliminäre Ligatur der Gefäße in der Leberpforte anzustreben. Zur temporären Unterbrechung der Blutzufuhr der Leber eignet sich ein Tourniquet um das Lig. hepatoduodenale, der deutlich atraumatischer als eine Gefäßklemme ist. Diese vorübergehende Okklusion der Blutzufuhr im Lig. hepatoduodenale wird auch als Pringle-Manöver bezeichnet.
Abklemmzeiten
Bei einer gesunden Leber werden Abklemmzeiten im Lig. hepatoduodenale bis zu 60 Minuten gut toleriert. Im eigenen Vorgehen wird zur Konditionierung mit einer Abklemmphase von fünf Minuten begonnen und der Fluss wieder für zehn Minuten freigegeben. Danach wird die Abklemmphase auf 15 Minuten beschränkt mit einer nachfolgenden Reperfusion von fünf Minuten. Dieses Vorgehen darf viermal wiederholt werden. Bei einer zirrhotischen Leber wird die Abklemmphase auf zehn Minuten beschränkt und darf zweimal wiederholt werden. Ob die intravenöse Gabe von Glucokortikoiden direkt vor der Klemmphase den Reperfusionsschaden abschwächt, ist nicht eindeutig bewiesen.
Vaskuläre Exklusion
Selbst bei einem Pringle-Manöver treten massive Blutungen auf, wenn die Lebervenen verletzt werden. Deshalb wird vor der Parenchymdurchtrennung häufig versucht, die zugehörige Lebervene ebenfalls zu ligieren, was bei der rechten Lebervene wenig problematisch ist. Die zum Teil komplexe intraparenchymatöse Anatomie der mittleren und linken Lebervene macht eine frühe Unterbindung manchmal technisch schwierig. Alternativ kann die V. cava inferior unter- und oberhalb der Lebervenen ebenfalls mit einem Tourniquet angeschlungen werden. Bei profuser Blutung kann die Leber damit vollständig vaskulär isoliert werden. Allerdings führt die Unterbindung der V. cava inferior nicht selten zu kardialen Problemen wegen der venösen Rückflussstörung.
Extrahepatische Resektion
Bei der eigentlichen Leberresektion werden zwei Methoden unterschieden: der extra- und intrahepatische Zugang. Beim extrahepatischen Zugang wird zunächst versucht, die zu- und abführenden Gefäße zu unterbinden, bevor das Parenchym durchtrennt wird. Die Strukturen werden im Leberhilus aufgesucht und die zugehörigen Gallenwege, die Arterie und der Pfortaderast durchtrennt. Dadurch demarkiert sich das zu resezierende Parenchym. Die anderen Leberabschnitte bleiben weiterhin perfundiert. Danach werden die drainierenden Lebervenen ligiert. Das Parenchym wird nun sukzessiv durchtrennt und alle größeren Gefäße gezielt unterbunden.
Intrahepatische Resektion
Beim intrahepatischen Vorgehen wird nach einem Pringle-Manöver das Parenchym primär durchtrennt und dabei alle größeren Gefäße einzeln ligiert und durchtrennt. Das Parenchym kann dabei optimal mit dem Ultraschall- (Cavitron Ultrasonic Surgical Aspirator – CUSA) oder Wasserstrahldissektor durchtrennt werden, ohne die Gefäßstrukturen zu verletzen. Eine blutarme Operation ist damit möglich, auch wenn sie mehr Zeit für die Dissektion erfordert.
Hepatotomie
Da sich Pfortader, Gallengang und Arterie innerhalb des Leberparenchyms mit der Glisson-Kapsel umgeben, wird von einigen Chirurgen vorgeschlagen, die Strukturen in der Leber aufzusuchen und dort zu unterbinden. Dazu wird über eine ventrale und dorsale Hepatotomie die Glisson-Kapsel umfahren und die Strukturen zum Beispiel mit einem Klammernahtgerät gemeinsam ligiert.
Lymphadenektomie
Bei cholangiocellulären Karzinom ist eine aggressive Resektion erforderlich, um die Prognose zu verbessern. Dazu gehört natürlich auch die Lymphadenektomie im Leberhilus und Lig. hepatoduodenale. Fraglichen Gewinn bringt die Lymphadenektomie bei retropankreatischen Lymphknotenmetastasen oder solchen entlang der A. hepatica communis.
Laparoskopische Resektion
Die laparoskopische Leberresektion bleibt Spezialisten vorbehalten, die mit allen konventionellen und laparoskopischen Techniken bestens vertraut sind.
Intraoperative Komplikation
Die häufigste Komplikation ist sicherlich die Blutung. Bei unbeabsichtigter Eröffnung der großen Lebervenen droht zudem eine Gasembolie.
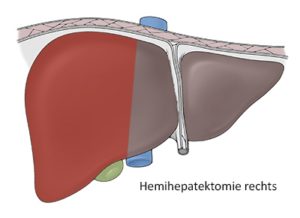
Hemihepatektomie rechts (Seg. 5-8)
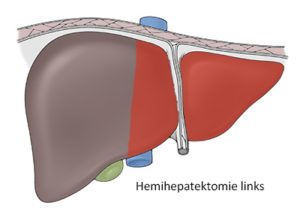
Hemihepatektomie links (Seg. 2-4)
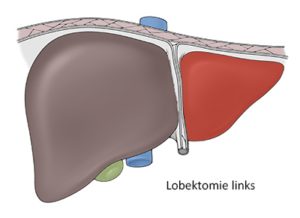
Lobektomie links (Seg. 2-3)

Trisektorektomie rechts (Seg. 4-8)
Postoperative Komplikationen
Postoperative Gefahren drohen von einer Nachblutung, Gallenfistel oder Ischämie des verbliebenen Leberrestes mit konsekutivem Leberversagen. Bei einer Nachblutung oder einer massiven Gallenfistel ist die unverzügliche Revision angezeigt. Um Gallelecks zu vermeiden, wird von einigen Autoren empfohlen, am Ende der Operation das Gallengangssystem mit Kochsalz zu füllen, um ein Galleleck bereits intraoperativ zu finden. Dazu kann der Zystikusstumpf nach der Cholezystektomie lang belassen bleiben. Nach einer Hemihepatektomie rechts kann der linke Leberlappen luxieren und die Gefäße abknicken, so dass eine Fixation des Lig. falciforme sinnvoll erscheint.
Nachbehandlung
Der Kostaufbau kann bereits mit Tee am ersten postoperativen Tag beginnen und dann zügig fortgesetzt werden, wenn der Patient Hunger verspürt und keine wesentlichen Manipulationen am Darm vorgenommen wurde. Eine Magensonde ist nicht erforderlich. Nach einer unkomplizierten Resektion ist keine Drainage erforderlich. Sollte dennoch eine Drainage erforderlich werden, dann wird sie regelmäßig auf eine Nachblutung oder Gallenfistel überprüft. Die Transaminasen, das Bilirubin und die Gerinnungswerte werden zunächst täglich kontrolliert, um eine Störung der Leberfunktion oder Galleableitung frühzeitig zu erkennen. Sonographisch wird die Durchblutung der Restleber kontrolliert und größere Biliome ausgeschlossen.
Leberregeneration
Nach einer Leberresektion regeneriert sich die Leber rasch, so dass die Funktion bereits nach acht bis 12 Wochen wiederhergestellt ist. Nach sechs Monaten hat die Leber meistens wieder ihre ursprüngliche Größe erreicht, indem die verbliebenen Segmente ihr Volumen durch Hyperplasie und Hypertrophie vergrößert haben.
Zirrhose
Leberresektionen bei Patienten mit einer Leberzirrhose sind besonders schwierig. Zunächst muss damit gerechnet werden, dass sich durch die Narbenbildung, Fibrose und Regeneratknoten die normale Anatomie verschoben hat. Zusätzlich wird das Gewebe durch die portale Hypertension sehr viel fragiler. Selbst die Mobilisation der Leber wird durch ausgedehnte Verwachsungen und kräftige atypische Gefäße erschwert.
Resektion bei Zirrhose
Selbst kleinere Leberresektionen können sich auf die verbleibende Leberfunktion deletär auswirken und zum Leberversagen führen, weil die funktionelle Reserve der Leber nicht exakt vorhersehbar ist. Postoperative Komplikationen wie Infektionen oder Nachblutungen können ein frühes Leberversagen triggern. Die Indikation zur Leberresektion wird deshalb auf kleine Tumoren mit weniger als fünf Zentimeter im Durchmesser und weniger als drei Tumorknoten beschränkt. Im Stadium Child-C verbietet sich jede Resektion. Im Stadium Child-B wird sie sehr selten gestellt.
Klassifikation der Schweregrade einer Leberzirrhose nach Child-Pugh
MELD-Score
Es wurde ein MELD-Score (Model for End-Stage Liver Disease) entwickelt, der eine verlässliche Prognose über die Sterblichkeit bei Leberzirrhose abgeben soll. Dieser MELD-Score basiert auf der Messung des Bilirubins, des Quicks und Kreatinins. Der MELD-Score wird zunehmend herangezogen, um die Dringlichkeit der Lebertransplantation zu ermitteln.
Die Formel lautet:
MELD= 3,8 * loge Bilirubin[mg/dl] + 11,2+loge (INR) + 9,6* loge Kreatinin [mg/dl] + 6,4
Bitte nicht per Hand berechnen, sondern den Internet basierten Score-Rechner verwenden.
Ungefähre 3-Monate-Sterblichkeit nach MELD-Score:
| MELD | 9 | 10-19 | 20-29 | 30-39 | 40 |
| Stationäre Therapie bei dekompensierter Leberzirrhose | 4% | 27% | 76% | 83% | 100% |
Thermoablation
Neben der Resektion von Lebertumoren werden immer häufiger interventionelle Verfahren empfohlen, die die Tumoren lokal entfernen. Man unterscheidet die chemoablativen Verfahren (perkutane Alkoholinstillation, transarterielle Chemotherapie bzw. Chemoembolisation) von den thermoablativen Verfahren. Von den letzteren hat sich die Radiofrequenzablation als sehr effektiv erwiesen. Um Tumoren zu entfernen, werden spezielle Sonden in den Tumor platziert, darüber eine definierte Wärmeenergie appliziert und somit eine kontrollierte Destruktionszone um die Sondenspitze geschaffen. Mit einfachen Sonden können Tumore mit einem Durchmesser von drei Zentimeter beseitigt werden, bei einem Sicherheitssaum von einem Zentimeter. Bei größeren Tumoren müssen sich die Ablationsbereich zwangsläufig überlappen. Mit der Thermoablation wurden bei Metastasen des kolorektalen Karzinoms dieselbe Überlebensraten erreicht wie nach der Resektion.